

Síndrome de intestino corto, un caso de readaptación intestinal
Short Bowel Syndrome, a Case of Intestinal Rehabilitation
Síndrome de intestino curto, um caso de readaptação intestinal
Síndrome de intestino corto, un caso de readaptación intestinal
Revista Ciencias de la Salud, vol. 13, no. 2, 2015
Universidad del Rosario
Recepción: 16 Septiembre 2014
Aprobación: 14 Febrero 2015
Resumen: Presentación del caso: El objetivo de este artículo es presentar la experiencia exitosa del manejo multidisciplinario de una paciente con síndrome de intestino corto y falla intestinal con evolución a la adaptación intestinal. Se trata de una recién nacida prematura con atresia intestinal tipo IV, con múltiples atresias intestinales, quien evolucionó a la falla intestinal y requirió manejo con soporte nutricional parenteral prolongado, múltiples esquemas antibióticos, probióticos, multivitaminas, nutrición enteral con fórmula elemental, hasta lograr su adaptación intestinal y llevar a una dieta normal. La falla intestinal en estos pacientes es un reto para el equipo de salud, ya que no solo implica el manejo quirúrgico de su condición de base, si no del soporte nutricional, equilibrio hidroelectrolítico, disfunción hepática por colestasis, infecciones asociadas, etcétera. Discusión: El síndrome de intestino corto con evolución a la falla intestinal en niños es una condición, cuya prevalencia va en aumento en el ámbito mundial, gracias a los avances en el cuidado intensivo neonatal, cirugía neonatal y en el soporte nutricional de pacientes con condiciones como gastrosquisis, onfalocele y enterocolitis necrotizante. A pesar de las limitaciones del sistema de salud, es posible ofrecer un tratamiento multidisciplinario e integral para llevarlos hasta la adaptación intestinal.
Palabras clave Síndrome intestino corto, falla intestinal, adaptación intestinal.
Abstract: Short bowel syndrome with progression to intestinal failure in children is a condition whose prevalence is increasing worldwide, thanks to advances in neonatal intensive care, neonatal surgery, and nutritional support of patients with conditions such as gastroschisis, omphalocele and enterocolitis. Objective: To present the successful experience of multidisciplinary management of a patient with short bowel syndrome and intestinal failure with progression to intestinal adaptation. Clinical case: A newly born premature with intestinal atresia type IV with multiple intestinal atresia, which evolved to intestinal failure and required management with prolonged parenteral nutritional support, multiple antibiotic schemes, prebiotics, multivitamins, enteral nutrition with elemental formula, in order to achieve their intestinal adaptation and enabling a normal diet. The evolution of these patients’ intestinal failure is a challenge for the health team, as it not only involves the surgical management of the patient’s condition, but the basic nutritional support, the fluid and electrolyte balance, hepatic dysfunction due to cholestasis associated infections, etc. Conclusion: Despite the limitations of our health care system, it is possible to offer a multidisciplinary and integrated treatment to lead to intestinal adaptation.
Keywords: Short bowel syndrome, intestinal failure, intestinal adaptation.
Resumo: Caso clínico: O objetivo é apresentar a experiência de sucesso do manejo multidisciplinar de uma paciente com síndrome de intestino curto e falha intestinal com evolução à adaptação intestinal. Se trata de uma recém nascida prematura com atresia intestinal tipo IV com múltiplas atresias intestinais que evolucionou à falha intestinal e requereu manejo com suporte nutricional parental prolongado, múltiplos esquemas antibióticos, probióticos, multivitaminas, nutrição enteral com fórmula elementar, até conseguir sua adaptação intestinal e levar a uma dieta normal. A falha intestinal nestes pacientes é um desafio para a equipe de saúde, devido a que não só implica o manejo cirúrgico de sua condição de base, mas também do suporte nutricional, equilíbrio hidroeletrolítico, disfunção hepática por colestase, infeções associadas, etc. Discussão: a síndrome de intestino curto com evolução à falha intestinal em crianças é uma condição cuja prevalência vai em aumento a nível mundial, devido aos avanços no cuidado intensivo neonatal, cirurgia neonatal e no suporte nutricional de pacientes com condições como gastrosquise, onfalocele e enterocolite. Apesar das limitações de nosso sistema de saúde, é possível oferecer um tratamento multidisciplinar e integral para leva-los até a adaptação intestinal.
Palavras-chave: Síndrome intestino curto, falha intestinal, adaptação intestinal.
Introducción
El síndrome de intestino corto es una condición cuya suma de alteraciones funcionales resultan de una reducción crítica en la longitud o función del intestino, en ausencia de un tratamiento adecuado, se manifiesta con diarrea crónica, deshidratación, desnutrición, deficiencia de nutrientes y electrolitos y, finalmente, con falla para crecer (1). La definición de intestino corto es aún muy controvertida, pero se coincide en que la longitud del intestino delgado es menor a 40 cm y se asocia con la falla intestinal, cuando el requerimiento de nutrición parenteral es mayor a 42 días (1, 2, 3).
Los casos de síndrome de intestino corto y la falla intestinal se encuentran en aumento, como resultado de los avances en los tratamientos quirúrgicos y médicos que se ofrecen a los neonatos con patologías de grave compromiso gastrointestinal (4, 5). Las patologías más frecuentes son la enterocolitis necrotizante, las alteraciones congénitas de la pared abdominal (onfalocele y gastrosquisis), las atresias intestinales múltiples y el vólvulos intestinal, con o sin malrotación, que representan más del 90 % de los casos (6).
La atención de estos pacientes es un reto para el equipo de salud. La aplicación del soporte nutricional parenteral brinda la posibilidad al paciente de mantenerse en crecimiento y conservar su estado de salud, en general, mientras se genera la readaptación intestinal que permita el desafío con nutrición enteral, si este proceso no es exitoso el paciente deberá someterse a un trasplante intestinal (7, 8).
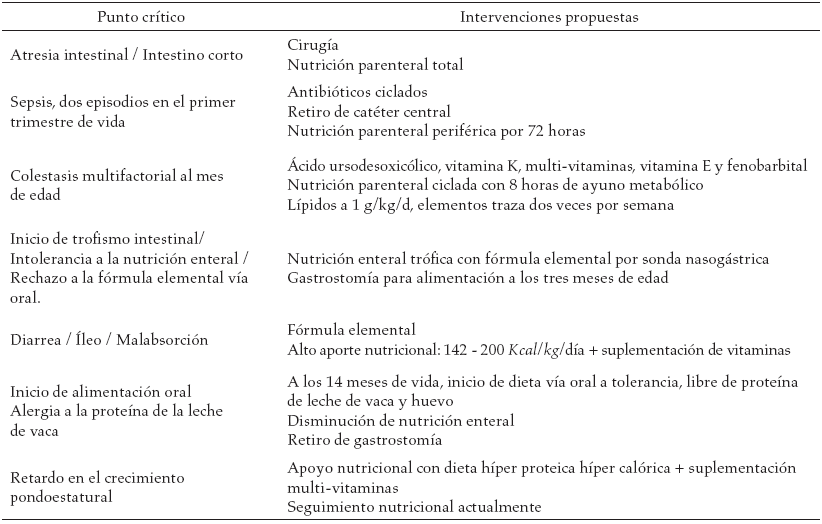
El objetivo es presentar el caso clínico de una paciente con síndrome de intestino corto, que evolucionó a falla intestinal y, después de la intervención por un grupo interdisciplinario (tabla 1), se puede decir que se ha logrado con éxito la adaptación intestinal.
Presentación del caso
Paciente de género femenino, fruto de la segunda gestación, madre de 34 años de edad, cuyo embarazo fue controlado, cursó con polihidramnios del tercer trimestre. Nace a las 34 semanas de edad gestacional, por vía cesárea, con Apgar de 7 al minuto y de 9 a los 5 minutos, buena adaptación neonatal. El peso al nacimiento fue de 1900 g y la talla de 45 cm. El peso y talla al nacer eran adecuados para la edad gestacional. En el periodo neonatal inmediato, la paciente presenta distención abdominal y vomito bilioso, se ingresa a cuidado intensivo neonatal, se deja sonda orogástrica a drenaje. La radiografía de abdomen inicial evidenció imagen de doble burbuja, en el segundo día de vida se llevó a cirugía, se encontró atresia duodenal y yeyunal múltiple (atresia intestinal tipo IV). Se realizó corrección quirúrgica de atresia duodenal en diamante y se corrigieron las múltiples atresias intestinales con tutor de silastic ®, se preservó la válvula íleocecal y la totalidad del colón, quedaron 40 cm de tercera porción de duodeno hasta la válvula ileocecal de intestino remanente.
Desde el posoperatorio inmediato se inició soporte nutricional parenteral total por catéter central. El aporte calórico inicial fue de 60 cal/ kg/día hasta 125 cal/kg/día, el cuarto día de vida. Por el íleo prolongado se continúa con nutrición parenteral total por infusión continua por cuatro semanas. Al mes de edad, la paciente presentó signos de colestasis multifactorial (sepsis, nutrición parenteral, no vía enteral, etcétera), con bilirrubina directa máxima de 8,8 mg/dl; transaminasa glutámico oxaloacetica (TGO): 80 U/L (valor referencia 15-55 U/L); transaminasa glutámico pirúvica (TGP): 119 U/L (valor referencia 6-45 U/L) y fosfatasa alcalina 444 U/L (valor referencia 73 A 367 U/L). Se manejó con ácido ursodesoxicólico, vitamina K, multi-vitaminas a dosis del doble del requerimiento calculado, vitamina A, vitamina E y fenobarbital. Una de las causas conocidas de la colestasis, es la nutrición parenteral prolongada, por lo cual se decide administrar la nutrición parenteral ciclada con ocho horas de ayuno metabólico, lo que mejora los niveles séricos de bilirrubinas. La nutrición parenteral ciclada se comenzó con un ayuno metabólico de 4 horas, al siguiente día fue de 6 horas y se conservó por otros 25 días en 8 horas. En el tiempo de ayuno metabólico, se mantuvo infusión de Dextrosa a un flujo de glucosa entre 8 y 12 mg/kg/minuto. Se tomaron controles estrictos de glicemia por punción, en las horas correspondientes a los cambios de volumen para la iniciación y el destete diario de la nutrición parenteral ciclada. Respecto de los aminoácidos, se mantuvo un aporte de 3 g/kg/día, en los lípidos se disminuyó el aporte en la nutrición ciclada a 1 g/kg/día, pero no fueron suspendidos. Los elementos traza se administraron a partir de los veinte días de nutrición parenteral solo dos veces por semana.
La alimentación enteral para estímulo del trofismo intestinal se inició con leche materna, al mes después de la intervención quirúrgica. Teniendo en cuenta el grado de resección intestinal y la malabsorción asociada, se consideró instaurar el soporte nutricional enteral con formula elemental.
Una complicación recurrente fue la hipokalemia e íleo asociado con las perdidas por diarrea, la paciente tenía en promedio 12 deposiciones líquidas al día, lo cual llevó a sospechar un síndrome de malabsorción. Para la evaluación de la capacidad de absorción se utilizó el test D-xilosa por espectrofotometría. La carga D-xilosa a ingerir por la paciente se calculó con base en el peso y la talla, y correspondió a 0,5 g vía enteral. A la hora exacta posterior a la ingesta se tomó la muestra de sangre, se halló un resultado de 12,9 mg/dl, el valor de referencia es mayor a 30mg/dl.
A los 3 meses de edad, motivado por episodios de broncoaspiración y reflujo gastroesofágico, se decide gastrostomía para alimentación. Al retirar el soporte nutricional parenteral, la paciente presentó periodos de ansiedad por falta de saciedad, por lo que se continuó un aporte enteral promedio de 200cc/kg/día y 142 kcal/kg/día, con un aporte nutricional mayor a lo requerido, para compensar las pérdidas por diarrea. La dilución de la fórmula fue del 15 %. Cuando se pretendió dar fórmulas más complejas, la paciente presentó episodios de intolerancia alimentaria, por lo que la fórmula elemental se mantuvo.
A los 6 meses de edad, se tomaron, mediante endoscopia, biopsias intestinales que señalaron esofagitis crónica con eosinofilia, cardioesofagitis crónica y subaguda con eosinofilia y gastritis crónica superficial. En intestino delgado se encontró hiperplasia neurogénica, calcificaciones intravasculares y ulceración de la mucosa. En el colón, se describió proctocolitis inespecífica. Se realizó, además, evaluación de los niveles de inmunoglobulinas que se reportaron normales, excepto la inmunoglobulina E, estuvo elevada para la edad. Se complementó este estudio con el test de alergia para alimentos, con resultado positivo para leche-betalactoglobulina, clara de huevo y yema de huevo.
A los nueve meses de edad, la paciente mostró mejoría en los signos de colestasis, bilirrubina directas 0,09 mg/dl, transaminasa glutámico oxaloacetica (TGO): 6,15 U/L (valor referencia 15- 55 U/L), transaminasa glutámico pirúvica (TGP): 33 U/L (valor referencia 6-45 U/L) y fosfatasa alcalina 222 U/L (valor referencia 73 A 367 U/L).
A los 14 meses de edad, se inició dieta con cereal de arroz, con buena tolerancia y, progresivamente, se incluyeron vegetales y proteína animal en preparaciones administradas por gastrostomía y vía oral. Se tomó nuevamente control de test D-xilosa, se encontró una capacidad de absorción de 30 mg/dl después de una hora de 0,5 g/kg oral, que corresponde a la normalidad. A los 2 años de vida se retira la gastrostomía, ya que la paciente recibe la dieta oral, se mantiene la restricción de huevo y leche de vaca.
Respecto del crecimiento pondoestatural, fue afectado negativamente, sin embargo, hay un aumento progresivo. La talla, aunque muestra ganancia, se mantiene para la edad inferior a -2DS, de igual manera para el peso se encuentra en -2DS. No obstante, el IMC (índice de masa corporal) para la edad se encuentra entre 0DS y +1DS.
En conjunto con el análisis nutricional, la respuesta a los alimentos y la mejoría clínica de la paciente, se puede sugerir que presenta una readaptación intestinal con recuperación de su función hepática y capacidad absortiva intestinal, sin requerimiento de nutrición parenteral actualmente y con una exitosa evolución.
Discusión
La incidencia de intestino corto en los recién nacidos es de 24,5 por cada 100 000 nacidos vivos, con una tasa de letalidad del 37,5 % (9). En el caso particular de Colombia, en el estudio realizado por Correa y colaboradores, se documentaron los defectos de la pared abdominal en recién nacidos en el Programa de Vigilancia de Malformaciones Congénitas de Bogotá, Colombia (BCMSP), entre enero de 2005 y abril de 2012, se encontró una prevalencia de gastrosquisis de 2,1 por 10 000 nacimientos y 1,2 por 10 000, para onfalocele, atresia esofágica e intestinal presentaron una prevalencia del 2 y 0,8 por 10 000 y hernia diafragmática congénita, 1,7 por 10 000 nacimientos (10). Alvarado Socarras y Rodríguez publicaron imágenes de un caso de acrodermatitis enteropática por intestino corto en un lactante que respondió positivamente a la suplementación de zinc, en Floridablanca, Colombia (11).
La clave para la supervivencia, después de una resección intestinal, es la capacidad de adaptación, la cual se encuentra limitada por la motilidad y la capacidad de absorción por parte del intestino remanente (2, 12). La nutrición parenteral es la única opción en estos casos para mantener el estado de salud sin deficiencias nutricionales, proporcionar suficientes nutrientes de acuerdo con los requerimientos y así facilitar el crecimiento (1). Aproximadamente, la mitad de los pacientes pediátricos con dependencia de nutrición parenteral desarrolla enfermedad hepática en la terapia, a largo plazo, aunque también intervienen otros factores de riesgo como el peso al nacer, nacimiento prematuro, el tiempo de aplicación de la nutrición parenteral, la falta de terapia enteral, sepsis, toxicidad por manganeso y la presencia de barro biliar, entre otras (3, 13).
La colestasis se define como la persistencia de bilirrubina directa superior a 2 mg/dl o 100 mmol/L2. Los niveles de bilirrubina directa, aumentada de manera persistente, pueden progresar a falla hepática (14). Los lípidos y la calidad de estos en la mezcla de nutrición parenteral son clave para prevenir la colestasis (15). Los fitoesteroles presentes en los lípidos por vía intravenosa pueden producir daños directos en el hígado o pueden impedir la síntesis de colesterol y la subsiguiente síntesis de ácidos biliares. El excesivo aporte de glucosa puede resultar en hígado graso y/o fibrosis hepática y, el exceso de proteínas, puede conducir a flujo de bilis reducida (4, 16).
La sepsis y, principalmente la asociada con el catéter, es una de las causas más frecuentes de morbilidad y mortalidad en niños con síndrome de intestino corto, los gérmenes pueden ser gram positivos, gram negativos e incluso hongos. El sobrecrecimiento bacteriano, la multi invasión, nutrición parenteral, catéter, desnutrición y la atrofia intestinal son factores de riesgo para que se presente la sepsis (12). Administrar los antibióticos enterales ciclados puede ser una alternativa para reducir la presencia de sepsis en estos pacientes con síndrome de intestino corto, donde la mayoría presenta algún episodio de infección durante la estancia hospitalaria y esta es la principal causa de muerte a corto plazo (17).
Para la evaluación de la absorción intestinal se realiza el test de D-xilosa, el cual proporciona información cualitativa y cuantitativa sobre la absorción intestinal. D-xilosa es una pentosa que se encuentra naturalmente en las plantas, su absorción incompleta permite que sea utilizada como una prueba de absorción. Otros monosacáridos se absorben mucho más ávidamente, incluso cuando el intestino delgado es anormal (18).
Mientras los estudios de hormonas tróficas están en curso, el método actual más fiable para facilitar la adaptación intestinal es proporcionar nutrición enteral, que también es clave para prevenir o revertir la enfermedad hepática secundaria a nutrición parenteral prolongada. La alimentación enteral, en infusión continua, sigue siendo la mejor opción. Para los pacientes que tienen el vaciamiento gástrico retardado, se aconseja la alimentación trans-pilórica (19).
La mayoría de publicaciones recomienda la nutrición enteral continua, utilizando la leche materna o fórmula elemental, la justificación para su uso se fundamenta en la prevención de alergia a la proteína de leche de vaca y en la mejora de la tolerancia a la nutrición enteral (2, 16). La paciente de este caso se sometió a un test de alergia para alimentos, siendo positivo para la proteína de la leche de vaca y huevo, por lo que se mantuvo la formula elemental por dos años. La paciente conservó la válvula ileocecal y la totalidad del colón, lo que mejoró el pronóstico. Sin embargo, el test D-xilosa evidenció una capacidad de absorción disminuida, por lo que se consideró la terapia nutricional parenteral, como opción para mantener su estado nutricional, entre tanto, se observaba efectividad de la nutrición enteral. En la nutrición parenteral aplicada a la paciente, se mantuvo el aporte de lípidos menor a 2 g/kg por día, se mantuvo el aporte suficiente de glucosa y proteínas. Se administró nutrición parenteral de forma ciclada, práctica ya reconocida como positiva en estos pacientes para mejorar la respuesta hepática (1, 3).
Los principios de la rehabilitación intestinal incluyen la restauración temprana de la continuidad intestinal, el uso de gastroclisis para alimentación, la administración de fórmula elemental para optimizar la absorción del enterocito, el alargamiento quirúrgico del intestino y el tratamiento agresivo con antibióticos de sobrecrecimiento bacteriano. La rehabilitación intestinal solo se asocia con éxito cuando se avanza en la alimentación enteral con la función del hígado conservada (19). En este caso en particular, se logró este objetivo y no se requirió cirugía para aumentar la superficie de absorción intestinal.
En el síndrome de intestino corto los retos están en relación no solo con mantener una nutrición adecuada, sino con enfrentarse a las complicaciones que aquejan a estos pacientes relacionados con sepsis, colestasis y daño hepático, diarrea de difícil manejo, déficit vitamínico y sus comorbilidades (1, 19). Este trabajo pretende llamar la atención sobre la atención oportuna e interdisciplinaria para garantizar un adecuado tratamiento y mejorar el pronóstico de los niños con síndrome de intestino corto y/o falla intestinal.
Agradecimientos
Agradecemos al Hospital Infantil Los Ángeles de Pasto, Colombia.
Referencias
1. 1. Valdovinos D, Cadena J, Montijo E, Zárate F, Cazares M, Toro E, et al. Síndrome de intestino corto en niños, actualidades en su diagnóstico y manejo. Rev Gastroenterol Mex. 2012;77(3):130-40.
2. 2. Sigalet D, Boctor D, Robertson M, Lam V, Brindle M, Sarkhosh K, et al. Improved outcomes in paediatric intestinal failure with aggressive prevention of liver disease. Eur J Pediatr Surg. 2009;19: 348-53.
3. 3. Khalil BA, Ba’ath ME, Aziz A, Forsythe L, Gozzini S, Murphy F, et al. Intestinal rehabilitation and bowel reconstructive surgery: improved outcomes in children with short bowel syndrome. J Pediatr Gastroenterol Nutr. 2012;54(4):505-9.
4. 4. Wessel JJ, Kocoshsis SA. Nutritional management of infants with short bowel syndrome. Semin Perinatol. 2007;31(2):104-11.
5. 5. Theyskens C, Dams A. Enteral nutrition regimen for neonates with short bowel syndrome. Nutrition. 2008;24(10):1045-7.
6. 6. Soler-Palacín P, Garzón-Lorenzo P, Castilla-Fernández Y, Arranz Amo JA, Scheider S, Tormo Carnicé R, et al. Acidosis D-láctica en un paciente de 11 años con síndrome de intestino corto. An Pediatr (Barc). 2006;64(4):385-7.
7. 7. Diamanti A, Conforti A, Panetta F, Torre G, Candusso M, Bagolan P, et al. Long-term outcome of home parenteral nutrition in patients with ultra-short bowel syndrome. J Pediatr Gastroenterol Nutr 2014;58(4):438-42.
8. 8. Avitzur Y, Grant D. Intestine Transplantation in Children: Update 2010. Pediatr Clin North Am. 2010;57(2):415-31.
9. 9. Wales PW, Allen N, Worthington P, George D, Compher C. The American Society for Parenteral and Enteral Nutrition, Teitelbaum D. A.S.P.E.N. Clinical Guidelines: Support of Pediatric Patients With Intestinal Failure at Risk of Parenteral Nutrition-Associated Liver Disease. JPEN J Parenter Enteral Nutr. 2014;38(5):538-57.
10. 10. Correa C, Mallarino C, Peña R, Rincón LC, Gracía G, Zarante I. Congenital malformations of pediatric surgical interest: prevalence, risk factors, and prenatal diagnosis between 2005 and 2012 in the capital city of a developing country. Bogotá, Colombia. J Pediatr Surg. 2014;49(7):1099-103.
11. 11. Alvarado-Socarras J, Rodríguez SC. Acrodermatitis enteropathica associated with short bowel syndrome. An Pediatr (Barc). 2013;79(3):191-2.
12. 12. Schalamon J, Mayr JM, Höllwarth ME. Mortality and economics in short bowel syndrome. Best Pract Res Clin Gastroenterol 2003;17(6):931-42.
13. 13. Fishbein TM, Matsumoto CS. Intestinal replacement therapy: Timing and indications for referral of patients to an intestinal rehabilitation and transplant program. Gastroenterology 2006;130: S147–151.
14. 14. Nasr A, Avitzur Y, Ng VL, De Silva N, Wales PW. The use of hyperbilirubinemia (>100 mmol/L) as an indicator of irreversible liver disease in infants with short bowel syndrome. J Pediatr Surg 2007;42(2):359-62.
15. 15. Gutierrez IM, Kang KH, Jaksic T. Neonatal short bowel syndrome. Semin Fetal Neonatal Med. 2011;16(3):157-63.
16. 16. Gong JF, Zhu WM, Yu WK, Li N, Li JS. Role of enteral nutrition in adult short bowel syndrome undergoing intestinal rehabilitation: the long-term outcome. Asia Pac J Clin Nutr. 2009;18(2):155-63.
17. 17. Dobson R, McGuckin C, Walker G, Lucas C, McGrogan P, Russell RK, et al. Cycled enteral antibiotics reduce sepsis rates in paediatric patients on long-term parenteral nutrition for intestinal failure. Aliment Pharmacol Ther. 2011;34:1005-11.
18. 18. Craig R, Ehrenpreis E. D-xylose testing. J Clin Gastroenterol. 1999;29(2):143-50.
19. 19. Javid PJ, Malone FR, Reyes J, Healey PJ, Horslen SP. The experience of a regional pediatric intestinal failure program: Successful outcomes from intestinal rehabilitation. Am J Surg. 2010;199(5):676-9.
Notas de autor
1 MSc
mayrenjd@gmail.com
Información adicional
Para citar este artículo: Ramírez-Prada D, Del
Castillo-Calderón G. Síndrome de intestino corto, un caso de readaptación
intestinal. Rev Cienc
Salud. 2015;13(2):309-316. doi: dx.doi.org/10.12804/revsalud13.02.2015.12
Descargos
de responsabilidad: Los autores
de este artículo son responsables de la información divulgada en este. No hay
conflictos de interés a declarar.